2025年脳科学研究が明かす真実
「マンジャロを使えば、食べたい欲求が消える」「食べ物のことを考えなくなった」――GLP-1受容体作動薬やGIP/GLP-1受容体作動薬(チルゼパチド)を使った肥満治療では、こうした体験談をよく耳にします。実際に、多くの方が劇的な体重減少を経験しています。
しかし一方で、「最初は効いていたのに、だんだん食欲が戻ってきた」「薬を続けているのに、また食べ物のことばかり考えるようになった」という声も聞かれます。なぜこのようなことが起こるのでしょうか?
2025年、世界的権威のある医学誌『Nature Medicine』に、この疑問に迫る画期的な研究が発表されました。Choi et al. (2025)の研究チームは、人間の脳に直接電極を埋め込んで脳波を測定するという、きわめて稀な方法で、チルゼパチド治療中の脳の変化を観察したのです(n=3)。
本記事では、この最新研究から明らかになった「食欲コントロール薬が脳にどう作用するのか」「なぜ効果が薄れることがあるのか」について、一般の方にもわかりやすく解説します。

目次
1. 「食べ物のことが頭から離れない」― 食物への執着とは?
肥満や過食症の方の多くが抱える深刻な悩み、それが「食物への執着(Food Preoccupation)」です。これは単なる「お腹が空いた」という感覚ではなく、「食べ物のことが常に頭から離れない」「食べることをコントロールできない感覚」を指します。
1-1 食物への執着が引き起こす問題
- コントロール喪失型の食行動: 食べることに対して自制が効かなくなる状態
- 過食エピソード: 短時間に大量の食べ物を摂取してしまう
- 精神的苦痛: 罪悪感、自己嫌悪、抑うつ感を伴う
- 体重増加の悪循環: 減量手術後でも体重が戻ってしまう原因に
研究によると、肥満症の患者さんの最大60%がこの症状に苦しんでいるとされています。
1-2 脳の報酬系と食欲の関係
食物への執着は、脳の「報酬系」と呼ばれる部分の異常と深く関わっています。特に重要なのが「側坐核(そくざかく / Nucleus Accumbens)」という部位です。
📌 側坐核とは?
脳の中で「快楽」や「やる気」を司る部位。食べ物を見たとき、匂いを嗅いだときに「食べたい!」という欲求を生み出す場所です。この部位が過剰に活性化すると、食べ物への執着が強まります。
2. チルゼパチド(マンジャロ)とは? なぜ食欲が抑えられるのか
チルゼパチドは、糖尿病治療薬として開発されましたが、強力な体重減少効果が注目され、肥満治療にも使用されるようになりました。日本では「マンジャロ」という商品名で知られています。
2-1 チルゼパチドの作用メカニズム
チルゼパチドはGIP/GLP-1受容体作動薬と呼ばれる薬剤です。2つのホルモン受容体に同時に働きかけることで、以下のような効果をもたらします:
- 血糖値のコントロール: インスリン分泌を促進し、血糖値を安定させる
- 満腹感の増強: 胃の動きをゆっくりにし、少量の食事で満足感を得られる
- 食欲の抑制: 脳の視床下部や報酬系に作用し、食欲そのものを減らす
- 体重減少: 臨床試験では平均15〜20%の体重減少が報告されている
2-2 「フードノイズ」が消える現象
チルゼパチドを使用した多くの患者さんが報告するのが、「フードノイズ(Food Noise)」の消失です。
💡 フードノイズとは?
「頭の中で常に食べ物のことを考えてしまう」「次に何を食べようか、いつも計画している」といった、食べ物に関する絶え間ない思考のこと。チルゼパチド使用者の多くが「この雑音が静かになった」と表現します。
3. 世界初の研究 ― 人間の脳に電極を埋め込んで食欲を測定
2025年に発表された研究は、きわめて稀な方法で行われました。肥満手術を受けても食物への執着が続く患者さんに同意を得て、脳の側坐核に直接電極を埋め込み、リアルタイムで脳波を測定したのです。
3-1 研究の概要
| 項目 | 内容 |
|---|---|
| 研究機関 | ペンシルベニア大学医学部 |
| 掲載誌 | Nature Medicine (2025年) |
| 対象者 | 重度肥満症で減量手術後も食物への執着が続く患者3名 |
| 方法 | 脳の側坐核に電極を埋め込み、日常生活中の脳波を記録 |
| 測定期間 | 手術後7か月間にわたる継続測定 |
3-2 画期的な発見: 「デルタ・シータ波」というバイオマーカー
研究チームは、食物への強い執着が起こるときに、側坐核で「デルタ・シータ波(7Hz以下の低周波脳波)」が顕著に増加することを発見しました。
🧠 デルタ・シータ波とは?
- 脳波の一種: 1秒間に7回以下の非常にゆっくりとした電気信号
- 執着状態の指標: 食べ物への強い執着があるとき、この脳波が急増する
- 予測マーカー: 実際に過食行動が起こる前から増加し始める
通常の状態(リラックス時)と食物への執着が強い状態を比較したところ、執着時にはデルタ・シータ波のパワー(強さ)が統計的に有意に高いことが確認されました(p < 0.00001)。
4. チルゼパチドの効果と「突破現象」― 驚くべき発見
この研究で最も注目すべきは、ある患者さん(参加者3)に起こった現象です。この方はチルゼパチドを糖尿病治療のために使用していました。
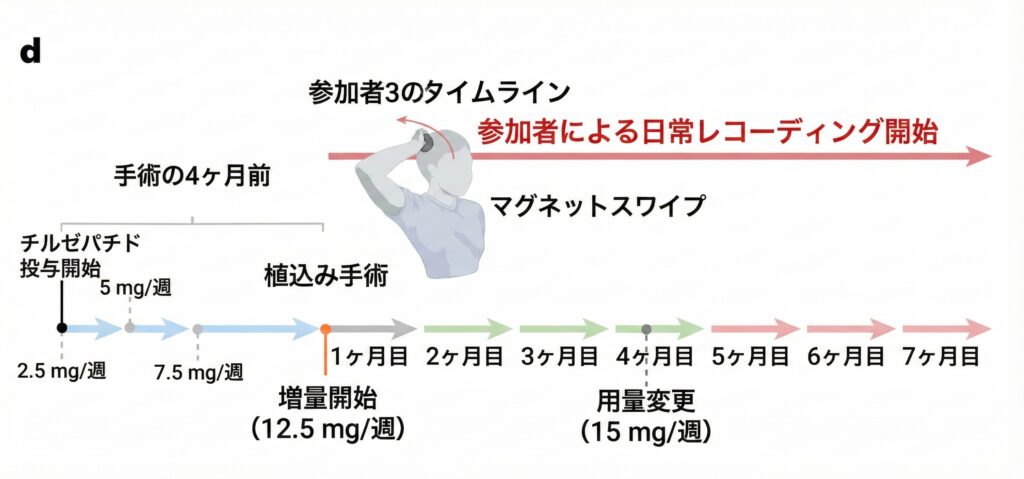 図1 参加者3の研究時の時系列 Choi et al. (2025) Fig.1dより1部改変
図1 参加者3の研究時の時系列 Choi et al. (2025) Fig.1dより1部改変
4-1 治療初期: 劇的な改善
手術後2〜4か月目(チルゼパチド増量期):
- ✅ 食物への強い執着エピソードがほぼ消失
- ✅ 体重が138kgから128kgへ減少(約7%減)
- ✅ 脳波測定でもデルタ・シータ波の異常な増加が見られない
- ✅ 「食べ物のことを考えなくなった」という自覚症状
この期間、患者さんの側坐核では、執着状態の脳波パターンが通常状態と区別がつかないレベルまで落ち着いていました(p = 0.81)。
4-2 5か月目以降: 「突破現象」の発生
ところが、手術後5〜7か月目に異変が起こりました:
⚠️ 脳波レベルの変化
- ● デルタ・シータ波が再び急増
- ● 左脳で p = 1.53×10⁻²²(統計的に極めて有意)
- ● 右脳で p = 1.09×10⁻⁶
📊 症状レベルの変化
- ● 食物への執着が再発
- ● 月7回の過食エピソード
- ● チルゼパチド最大量投与中にも関わらず
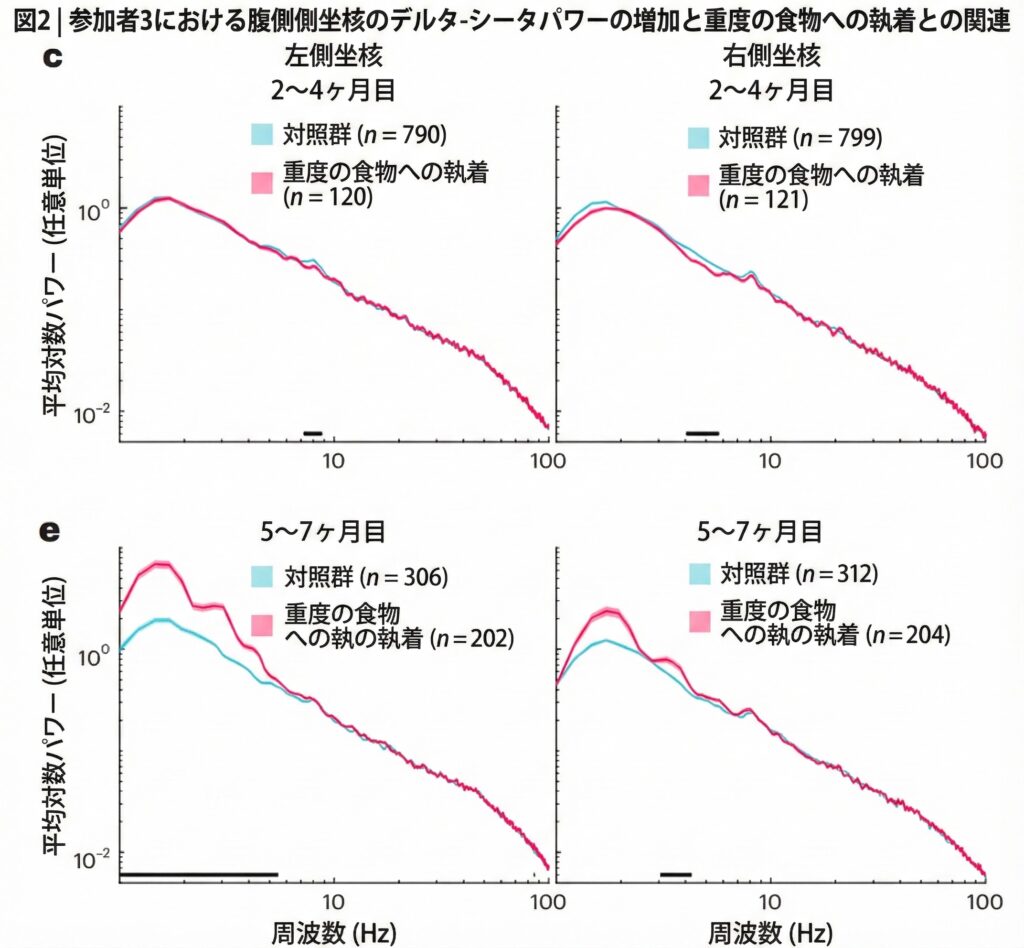
図2 参加者3における腹側NAcのデルタ-シータ波パワー増加と深刻な食物執着の関連性(参加者がリラックス状態(対照群、青)または重度の食物執着状態(ピンク)にある際の比較):
c 参加者3(腹側NAc):パワースペクトル(平均±標準誤差)
・2~4か月目には、手術前のベースライン値と比較して体重が7%減少した(138–128 kg)。
e 5~7か月目のパワースペクトル(平均±標準誤差
・パワースペクトル(平均±標準誤差)(e)5~7か月分のデータをcと同様の形式で表示。
4-3 重要な発見: 脳波が症状より先に変化する
さらに驚くべきことに、デルタ・シータ波の増加は、実際の症状再発よりも約7週間早く始まっていたことが判明しました。
⏰ タイムラインの意味
脳波の変化が「予兆」として現れることで、将来的には「症状が悪化する前に治療を調整できる可能性」が示されました。これは肥満治療における画期的な発見です。
5. なぜ薬が効かなくなるのか? 「耐性」のメカニズム
この研究結果は、多くの患者さんが経験する「最初は効いたのに、だんだん効かなくなる」という現象の神経科学的な説明を提供しています(n=1)。
5-1 考えられる3つの仮説
仮説1: 受容体のダウンレギュレーション
長期間の薬剤投与により、脳のGIP/GLP-1受容体が減少したり、感受性が低下したりする可能性。これにより同じ量の薬でも効果が弱まる。
仮説2: 脳回路の代償メカニズム
薬によって抑えられていた食欲システムが、別の経路を活性化させて「回避ルート」を作り出す可能性。脳は恒常性を保とうとするため、抑制された機能を別の方法で補おうとする。
仮説3: 側坐核の神経可塑性
側坐核の神経回路が時間とともに「学習」し、薬の効果を打ち消す新しいパターンを形成する可能性。今回発見されたデルタ・シータ波の再出現は、この神経可塑性の表れかもしれない。
5-2 他の研究でも報告される「耐性現象」
実は、GLP-1受容体作動薬における食欲抑制効果の減弱は、他の研究でも指摘されています:
- リラグルチド(サクセンダ)の研究では、治療初期に見られた「フードノイズ」の減少効果が、時間とともに弱まることが報告されています(Tronieri et al., 2020)
- セマグルチド(ウゴービ)の2年間追跡研究でも、食欲コントロールへの効果が経時的に低下する傾向が観察されました(Wharton et al., 2023)
6. この研究が示す未来の治療法
今回の発見は、単に「なぜ効かなくなるのか」を説明するだけでなく、未来の個別化された肥満治療への道を開く可能性があります。
6-1 バイオマーカーに基づく治療調整
🔬 将来の可能性
- 早期発見: 脳波モニタリングで症状再発の「予兆」を7週間前にキャッチ
- 先制的介入: 症状が出る前に薬の量を調整したり、別の治療を追加したりできる
- 客観的評価: 患者さんの主観的な報告だけでなく、脳の状態を客観的に測定
- 治療最適化: 個々の患者さんの脳反応に合わせた最適な治療法を選択
6-2 非侵襲的モニタリングへの応用
現在の研究では脳に電極を埋め込む侵襲的な方法が使われましたが、将来的には頭皮から測定する脳波(EEG)で同様のバイオマーカーを検出できる可能性があります。
実際、パーキンソン病では、脳深部の異常な脳波(ベータ波)が頭皮脳波でも検出できることが確認されています。同様の技術が肥満治療にも応用できれば、簡単な検査で治療効果をモニタリングできるようになるかもしれません。
6-3 複合的治療アプローチ
この研究は、薬物治療だけでなく、以下のような複合的アプローチの重要性も示唆しています:
- 認知行動療法: 脳波が変化し始めたら、心理療法を強化する
- 脳刺激療法: 研究では応答型脳深部刺激(rDBS)も試されており、将来的な選択肢に
- 薬剤の組み合わせ: 異なる作用機序を持つ薬を併用して耐性を防ぐ
- 間欠的投与: 連続投与ではなく、計画的な休薬期間を設ける
7. 研究の限界と今後の課題
この画期的な研究にも、いくつかの限界があります。研究者たち自身も以下の点を認めています。
| 限界点 | 説明 | 今後の課題 |
|---|---|---|
| 症例数が少ない | わずか3名の患者のデータ | より多くの患者での検証が必要 |
| 対照群がない | チルゼパチドを使わない群との比較がない | 無作為化対照試験での確認 |
| 特殊な患者群 | 減量手術後も症状が続く重症例のみ | 一般的な肥満患者への適用可能性の検証 |
| 他の要因の影響 | 手術後の回復、時間経過など他の要因を排除できない | より厳密にコントロールされた研究デザイン |
| 薬の中止が不可能 | 糖尿病治療のため薬を止められない | 倫理的に配慮した研究計画の立案 |
8. 患者さんへのメッセージ ― この研究から何を学ぶか
チルゼパチド(マンジャロ)やその他のGLP-1受容体作動薬を使用中、または使用を検討している方にとって、この研究は重要な示唆を与えてくれます。
8-1 「効果が薄れる」のは珍しくない
✅ 知っておくべきこと
- 薬の効果が時間とともに変化するのは、あなたの意志が弱いからではありません
- 脳の神経回路が適応する、自然な生理学的現象です
- 「効かなくなった」と感じたら、自己判断せず必ず医師に相談してください
- 用量調整や治療法の変更で改善する可能性があります
8-2 薬だけに頼らない総合的アプローチが重要
この研究は、薬物治療は強力なツールだが、万能ではないことを示しています。最も効果的な肥満治療は:
- 薬物療法 + 行動療法 + 栄養指導 + 運動療法
- 定期的な医師とのコミュニケーション
- 心理的サポート(必要に応じて)
- 長期的な視点での体重管理
8-3 未来への希望
今回の研究は、肥満治療の未来に明るい展望を示しています:
🌟 期待できる未来
- 個別化医療: あなたの脳の状態に合わせた治療が可能に
- 予測的介入: 症状が悪化する前に対処できる
- 新しい治療標的: デルタ・シータ波を直接調整する治療法の開発
- より効果的な薬: 耐性が生じにくい次世代の治療薬
9. まとめ
2025年Nature Medicineに発表された研究は、チルゼパチド治療における食欲コントロールのメカニズムと、その効果が時間とともに変化する現象を、脳科学的に初めて解明しました。
📋 重要ポイントのまとめ
- 脳の側坐核で「デルタ・シータ波」が食物への執着のバイオマーカーとして機能することが判明
- チルゼパチド治療初期には脳波が正常化し、食欲が劇的に抑制される
- 5か月目以降、デルタ・シータ波が再出現し、症状が「突破」する現象が観察された
- 脳波の変化は症状再発より約7週間早く現れ、予測マーカーとしての可能性を示す
- 薬の効果減弱は神経回路の適応による自然現象であり、患者さんの責任ではない
- 将来的には脳波モニタリングで個別化された治療調整が可能になるかもしれない
肥満治療は長い道のりです。しかし、このような最先端の研究が、より効果的で持続可能な治療法の開発につながっています。薬の効果に変化を感じたら、一人で悩まず、必ず医療チームに相談してください。
🏥 M&B美容皮フ科クリニックからのメッセージ
当院では、最新のエビデンスに基づいた肥満治療を提供しています。GLP-1受容体作動薬を使用した治療では、単に薬を処方するだけでなく、定期的なモニタリングと包括的なサポートを行っています。治療効果の変化や不安なことがあれば、いつでもご相談ください。
よくある質問(FAQ)
まず重要なのは、自己判断で薬を中止したり増量したりしないことです。効果の減弱を感じたら、必ず担当医に相談してください。
医師が検討する選択肢:
- 用量調整: 適切な範囲内での増量を検討
- 投与間隔の見直し: 投与スケジュールの最適化
- 併用療法: 行動療法や栄養指導の強化
- 薬剤の変更: 他のGLP-1受容体作動薬への切り替え
- 休薬期間: 計画的な休薬で受容体の感受性を回復させる(医師の指導下で)
今回の研究が示すように、効果の変化は脳の適応による自然な現象であり、あなたの意志の問題ではありません。専門家と相談しながら、最適な対応策を見つけることが大切です。
いいえ、効果には個人差があります。今回の研究は重度肥満で減量手術後も症状が続く特殊な患者群(n=3)を対象としており、一般的な肥満患者さんへの適用可能性はまだ検証が必要です。
効果に影響する可能性のある要因:
- 肥満のタイプ: 食欲過多型、代謝異常型など原因によって異なる
- 遺伝的要因: GLP-1受容体の遺伝的多型
- 併存疾患: 糖尿病、甲状腺疾患などの有無
- 心理的要因: ストレス性の過食、摂食障害の既往
- 生活習慣: 睡眠、運動、食事パターンの影響
そのため、個別化されたアプローチが重要です。定期的な診察で効果をモニタリングし、あなたに最適な治療計画を調整していくことが成功の鍵となります。
残念ながら、現時点ではまだ直接的な臨床応用はできません。今回の研究は重要な科学的発見ですが、いくつかの限界があります:
現状の限界:
- 侵襲的な測定: 脳波測定には脳への電極埋め込みが必要(研究のみで臨床的には実施困難)
- 少数の症例: わずか3名のデータであり、大規模検証が必要
- 特殊な患者群: 重症例のみが対象で、一般化には慎重さが必要
しかし、この研究から得られる実践的な知見:
- 薬の効果減弱は科学的に説明できる現象であること
- 定期的なモニタリングの重要性
- 総合的アプローチ(薬+行動療法+栄養指導)の必要性
- 将来的な個別化医療への期待
現在の治療では、これらの知見を踏まえつつ、確立されたエビデンスに基づいた標準的な治療を受けることが最も安全で効果的です。
CONTACT
まずはお気軽にLINEでご相談ください!
費用は
どのくらい?
ダウンタイムは?
美容医療
初心者でも
大丈夫?
何回
通えばいい?
どの治療が
いいか
分からない
ご予約は「お電話」
または「LINE」から
関連記事
【痩せるだけじゃない】マンジャロの効果
マンジャロの基本的なダイエット効果から、医療の未来を変えるかもしれない驚くべき最新の研究まで、その全貌を分かりやすく解説します。
続きを読む →
恐怖の“オゼンピック顔”はマンジャロでも起こる?
「マンジャロで痩せたいけれど、SNSで見かける『オゼンピック顔』という言葉が気になる…」。そんな不安を抱えていませんか。
続きを読む →
参考文献
- Choi, W., Nho, Y.H., Qiu, L., et al. (2025). Brain activity associated with breakthrough food preoccupation in an individual on tirzepatide. Nature Medicine. https://doi.org/10.1038/s41591-025-04035-5
- Hayashi, D., et al. (2023). What is food noise? A conceptual model of food cue reactivity. Nutrients, 15, 4809.
- Tronieri, J.S., et al. (2020). Effects of liraglutide on appetite, food preoccupation, and food liking: results of a randomized controlled trial. International Journal of Obesity, 44, 353-361.
- Wharton, S., et al. (2023). Two-year effect of semaglutide 2.4 mg on control of eating in adults with overweight/obesity: STEP 5. Obesity, 31, 703-715.
- Wadden, T.A., et al. (2023). Tirzepatide after intensive lifestyle intervention in adults with overweight or obesity: the SURMOUNT-3 phase 3 trial. Nature Medicine, 29, 2909-2918.
- Allison, K.C., et al. (2023). A pilot randomized controlled trial of liraglutide 3.0 mg for binge eating disorder. Obesity Science & Practice, 9, 127-136.
- Rossi, M.A. & Stuber, G.D. (2018). Overlapping brain circuits for homeostatic and hedonic feeding. Cell Metabolism, 27, 42-56.





